Mediante
la “síntesis”, el hombre puede transformar los compuestos naturales y fabricar
moléculas distintas o producir compuestos escasos en la naturaleza o que son
difíciles de obtener en forma natural. Cuando un carbono está unido a 4 grupos
distintos (carbono asimétrico o quiral) pueden existir 2 moléculas diferentes (isómeros)
que son como nuestras manos: una es la imagen en el espejo de la otra, se
llamaron “enantiomorfos o enantiómeros” (de enantio
= contrario y morph = forma) por
diferir en la distribución de sus átomos o grupos y se designan como “R” y “S”.
(ver temas 35 y 80 de AQV).
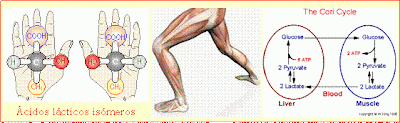
Las
propiedades de los enantiómeros son tan similares que, por ejemplo, los 2
ácidos lácticos fueron considerados idénticos por muchos años. Sin embargo, su
comportamiento dentro de los seres vivos puede ser muy diferente. Así, el
R-limoneno tiene olor a naranja, mientras el S-limoneno huele a limón. En el
caso de los fármacos estas diferencias pueden ser muy relevantes; por ejemplo,
el S-ibuprofeno es analgésico y anti-inflamatorio y el R-ibuprofeno no lo es.
Por mucho tiempo, los métodos utilizados por el hombre para sintetizar estos
compuestos no han sido muy eficientes ya que en vez de obtener uno de los
isómeros producen una mezcla de ambos (“racemato o mezcla racémica”).
En 1958 ya se
notaba en Alemania el incremento de estas malformaciones, pero se ignoraba la causa
hasta que, en 1961, el médico alemán Widukind Lenz halló 14 casos y alertó que la
causante era la talidomida. Pocos días después, el fármaco fue retirado del
mercado alemán. Posteriormente se conoció que la talidomida utilizada
era el racemato: la R-talidomida
tiene las propiedades sedantes deseadas y la S-talidomida produce
malformaciones en el feto (teratogénico). Se cree que produjo unas 20 mil víctimas.
La comercialización
de la talidomida nunca fue aprobada en Estados Unidos gracias al
profesionalismo de la Dra.
Frances Oldham Kelsey, una farmacóloga con gran experiencia
en temas toxicológicos y recién incorporada a la Food and Drug Administration
(FDA) quien consideró insuficientes las pruebas realizadas. Según los
fabricantes, el fármaco se administró durante varias semanas a conejas, monos,
ratas y perras embarazadas, sin producir efectos secundarios. Después se halló que
las pruebas se hicieron en forma incorrecta y se falsearon los resultados. Pruebas posteriores en conejos y monos
producen los mismos efectos terribles como en los seres humanos.
El Dr.
Hiroshi Harada y sus colaboradores del Tokyo Institute of Technology
descubrieron que la talidomida inactiva una enzima importante en el desarrollo
de los miembros del feto. Durante las semanas 3 a 8 de la gestación, el
embrión mide sólo unos milímetros y para crecer necesita un aporte extra de
oxígeno y nutrientes. Si la talidomida llega en este periodo, inhibe la
formación de nuevos vasos sanguíneos y, por esto, el aporte de nutrientes y de oxígeno
es deficiente. Actualmente,
la talidomida se usa en el tratamiento de enfermedades como lepra, ciertos
tipos de cáncer, el eritema nudoso leproso, el mieloma múltiple y otras
afecciones severas y poco usuales. Cuando es recetada deben seguirse
estrictamente las indicaciones.
Esta tragedia cambió el modo en que los fármacos se desarrollan, se prueban y se autoriza su comercialización. Actualmente, para aprobar un medicamento debe ser sometido a un largo y riguroso proceso de estudio. Además, ya existen métodos de síntesis que permiten fabricar sólo el enantiómero con actividad farmacológica, ya que la separación del racemato es difícil y costosa. En el año 2001, el Premio Nobel de Química fue concedido a los investigadores William S. Knowles (norteamericano), Ryoji Noyori (japonés) y K. Barry Sharpless (norteamericano) por sus aportes en este campo.
BIBLIOGRAFÍA
Q.F. JUAN JSOÉ LEÓN CAM <jjleon@lamolina.edu.pe>
Departamento de Química. Universidad Nacional Agraria La Molina. PERÚ